ნოზოკომიური პნევმონია ყველაზე გავრცელებული და სერიოზული ნოზოკომიური ინფექციაა, რომლის 40%-ს ვენტილატორთან ასოცირებული პნევმონია (VAP) შეადგენს. რეფრაქტერული პათოგენებით გამოწვეული VAP კვლავ რთულ კლინიკურ პრობლემას წარმოადგენს. წლების განმავლობაში, გაიდლაინები VAP-ის პრევენციისთვის რეკომენდაციას უწევდა ინტერვენციების ფართო სპექტრს (როგორიცაა მიზანმიმართული სედაცია, თავის აწევა), თუმცა VAP ტრაქეალური ინტუბაციის მქონე პაციენტების 40%-მდე გვხვდება, რაც იწვევს ჰოსპიტალიზაციის გახანგრძლივებას, ანტიბიოტიკების გამოყენების ზრდას და სიკვდილს. ადამიანები ყოველთვის ეძებენ უფრო ეფექტურ პრევენციულ ზომებს.
ვენტილატორთან ასოცირებული პნევმონია (VAP) პნევმონიის ახალი ფორმაა, რომელიც ტრაქეის ინტუბაციიდან 48 საათის შემდეგ ვითარდება და ინტენსიური თერაპიის განყოფილებაში (ICU) ყველაზე გავრცელებულ და სასიკვდილო ნოზოკომიურ ინფექციას წარმოადგენს. ინფექციური დაავადებების ამერიკული საზოგადოების 2016 წლის სახელმძღვანელო მითითებები VAP-ს განასხვავებს საავადმყოფოში შეძენილი პნევმონიის (HAP) განმარტებისგან (HAP ეხება მხოლოდ პნევმონიას, რომელიც ვითარდება ტრაქეალური მილის გარეშე ჰოსპიტალიზაციის შემდეგ და არ არის დაკავშირებული მექანიკურ ვენტილაციასთან; VAP არის პნევმონია ტრაქეის ინტუბაციისა და მექანიკური ვენტილაციის შემდეგ), ხოლო ევროპული საზოგადოება და ჩინეთი მიიჩნევენ, რომ VAP კვლავ HAP-ის განსაკუთრებული ტიპია [1-3].
მექანიკურ ვენტილაციაზე მყოფ პაციენტებში, ვენტილაციის აპნოეს შემთხვევები 9%-დან 27%-მდე მერყეობს, სიკვდილიანობის მაჩვენებელი დაახლოებით 13%-ია და შეიძლება გამოიწვიოს სისტემური ანტიბიოტიკების გამოყენების ზრდა, მექანიკური ვენტილაციის გახანგრძლივება, ინტენსიური თერაპიის განყოფილებაში ხანგრძლივი ყოფნის პერიოდი და ხარჯების ზრდა [4-6]. არაიმუნოდეფიციტურ პაციენტებში HAP/VAP ჩვეულებრივ გამოწვეულია ბაქტერიული ინფექციით და გავრცელებული პათოგენების განაწილება და მათი რეზისტენტობის მახასიათებლები განსხვავდება რეგიონის, საავადმყოფოს კლასის, პაციენტთა პოპულაციისა და ანტიბიოტიკების ზემოქმედების მიხედვით, ასევე დროთა განმავლობაში იცვლება. Pseudomonas aeruginosa დომინირებდა ვენტილაციის აპნოესთან დაკავშირებულ პათოგენებში ევროპასა და ამერიკაში, ხოლო ჩინეთის მესამეულ საავადმყოფოებში Acinetobacter baumannii-ს მეტი სახეობა იქნა იზოლირებული. ვენტილაციის აპნოესთან დაკავშირებული ყველა სიკვდილიანობის ერთი მესამედიდან ერთ ნახევარამდე პირდაპირ გამოწვეულია ინფექციით, ხოლო Pseudomonas aeruginosa-თი და acinetobacter-ით გამოწვეული შემთხვევების სიკვდილიანობის მაჩვენებელი უფრო მაღალია [7,8].
ვენტილატორის ენცეფალოპათიის (VAP) ძლიერი ჰეტეროგენულობის გამო, მისი კლინიკური გამოვლინებების, ვიზუალიზაციისა და ლაბორატორიული ტესტების დიაგნოსტიკური სპეციფიკურობა დაბალია, ხოლო დიფერენციალური დიაგნოზის დიაპაზონი ფართოა, რაც ართულებს ვენტილატორის ენცეფალოპათიის დროულად დიაგნოსტირებას. ამავდროულად, ბაქტერიული რეზისტენტობა სერიოზულ გამოწვევას წარმოადგენს ვენტილატორის ენცეფალოპათიის მკურნალობისთვის. შეფასებულია, რომ ვენტილატორის ენცეფალოპათიის განვითარების რისკი მექანიკური ვენტილაციის გამოყენების პირველი 5 დღის განმავლობაში დღეში 3%-ია, 5-დან 10 დღემდე - დღეში 2%-ს, ხოლო დანარჩენი დროის განმავლობაში - დღეში 1%-ს. პიკური შემთხვევები, როგორც წესი, ვენტილაციის 7 დღის შემდეგ ფიქსირდება, ამიტომ არსებობს ფანჯარა, რომლის განმავლობაშიც ინფექციის ადრეული პრევენციაა შესაძლებელი [9,10]. მრავალი კვლევა ვენტილატორის ენცეფალოპათიის პრევენციას ეხებოდა, მაგრამ ვენტილატორის ენცეფალოპათიის პრევენციის ათწლეულების განმავლობაში ჩატარებული კვლევისა და მცდელობების მიუხედავად (როგორიცაა ინტუბაციის თავიდან აცილება, რეინტუბაციის თავიდან აცილება, სედაციის შემცირება, საწოლის თავის 30°-დან 45°-მდე აწევა და პირის ღრუს მოვლა), შემთხვევები, როგორც ჩანს, არ შემცირებულა და მასთან დაკავშირებული სამედიცინო ტვირთი ძალიან მაღალი რჩება.
ინჰალაციური ანტიბიოტიკები ქრონიკული სასუნთქი გზების ინფექციების სამკურნალოდ 1940-იანი წლებიდან გამოიყენება. რადგან მას შეუძლია მაქსიმალურად გაზარდოს წამლების მიწოდება ინფექციის სამიზნე ადგილას (ანუ სასუნთქ გზებში) და შეამციროს სისტემური გვერდითი მოვლენები, მან კარგი გამოყენება აჩვენა სხვადასხვა დაავადებების დროს. ინჰალაციური ანტიბიოტიკები ამჟამად დამტკიცებულია აშშ-ის სურსათისა და წამლის ადმინისტრაციის (FDA) და ევროპის მედიკამენტების სააგენტოს (EMA) მიერ კისტოზური ფიბროზის სამკურნალოდ. ინჰალაციურ ანტიბიოტიკებს შეუძლიათ მნიშვნელოვნად შეამცირონ ბაქტერიული დატვირთვა და ბრონქოექტაზიის გამწვავებების სიხშირე საერთო გვერდითი მოვლენების გაზრდის გარეშე და ამჟამინდელი გაიდლაინები მათ აღიარებს, როგორც პირველი რიგის მკურნალობას pseudomonas aeruginosa ინფექციის და ხშირი გამწვავებების მქონე პაციენტებისთვის; ფილტვის ტრანსპლანტაციის პერიოპერაციულ პერიოდში ინჰალაციური ანტიბიოტიკები ასევე შეიძლება გამოყენებულ იქნას როგორც დამხმარე ან პროფილაქტიკური პრეპარატები [11,12]. თუმცა, 2016 წლის აშშ-ის VAP გაიდლაინებში, ექსპერტებს არ ჰქონდათ ნდობა დამხმარე ინჰალაციური ანტიბიოტიკების ეფექტურობაში, დიდი, რანდომიზებული კონტროლირებადი კვლევების არარსებობის გამო. 2020 წელს გამოქვეყნებულმა მე-3 ფაზის კვლევამ (INHALE) ასევე ვერ მიიღო დადებითი შედეგები (ვაგინალური აფეთქების საწინააღმდეგო პაციენტებით გამოწვეული გრამუარყოფითი ბაქტერიული ინფექციის სამკურნალოდ ინჰალაციური ამიკაცინის დახმარებით ინტრავენური ანტიბიოტიკები, ორმაგად ბრმა, რანდომიზებული, პლაცებოთი კონტროლირებადი, მე-3 ფაზის ეფექტურობის კვლევა, სულ 807 პაციენტი, სისტემური მედიკამენტები + ამიკაცინის დახმარებით ინჰალაცია 10 დღის განმავლობაში).
ამ კონტექსტში, საფრანგეთში, ტურისის რეგიონალური უნივერსიტეტის საავადმყოფოს ცენტრის (CHRU) მკვლევარების ხელმძღვანელობით შექმნილმა გუნდმა განსხვავებული კვლევითი სტრატეგია აირჩია და ჩაატარა მკვლევარის მიერ ინიცირებული, მრავალცენტრიანი, ორმაგი ბრმა, რანდომიზებული კონტროლირებადი ეფექტურობის კვლევა (AMIKINHAL). ინჰალაციური ამიკაცინი ან პლაცებო VAP პრევენციისთვის შედარებული იქნა საფრანგეთში 19 ინტენსიური თერაპიის განყოფილებაში [13].
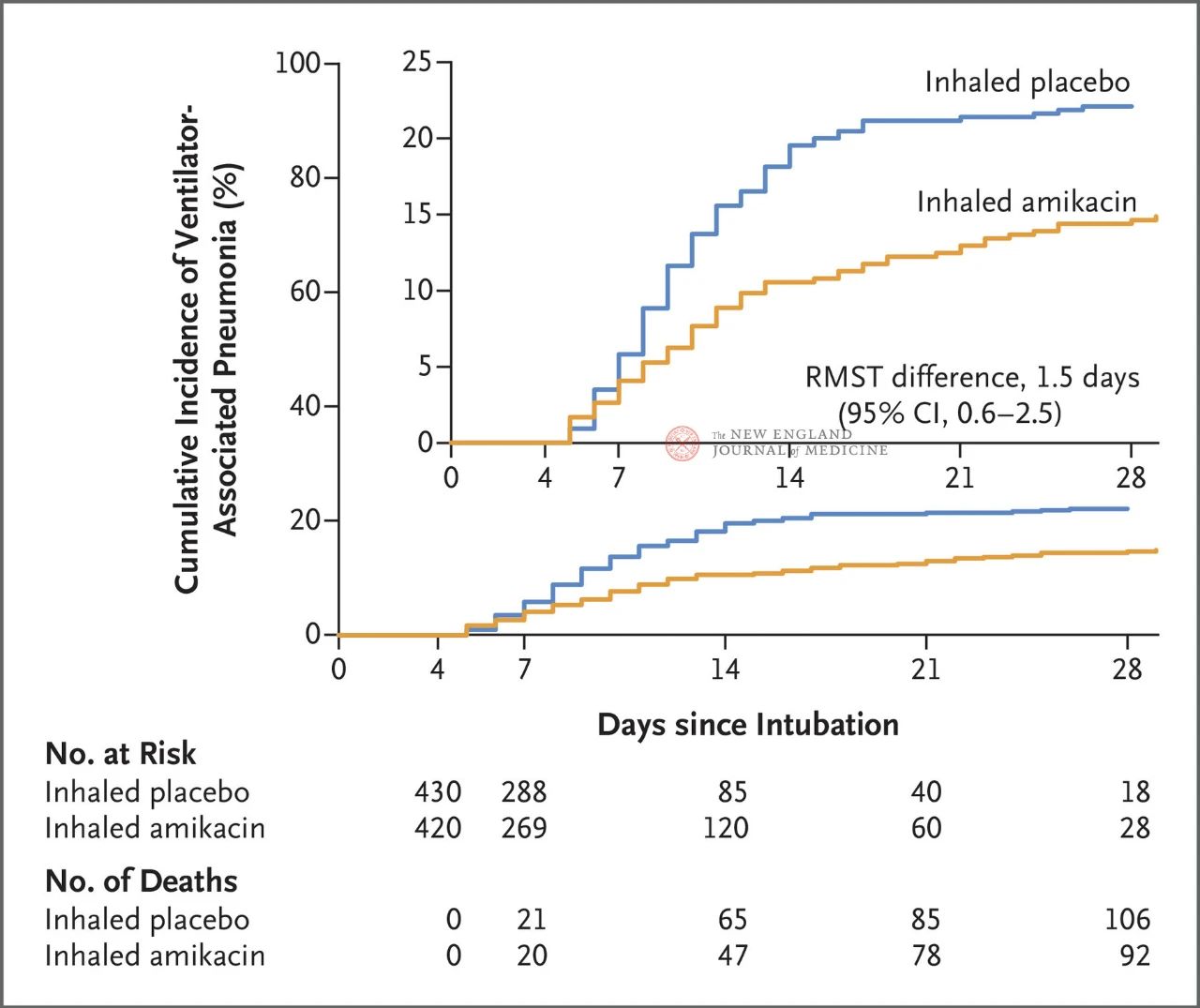
ინვაზიური მექანიკური ვენტილაციის მქონე 847 ზრდასრული პაციენტი 72-დან 96 საათამდე პერიოდში შემთხვევითი შერჩევის პრინციპით განაწილდა 1:1 თანაფარდობით ამიკაცინის ინჰალაციის (N= 417,20 მგ/კგ სხეულის იდეალური წონა, QD) ან პლაცებოს ინჰალაციის (N=430, 0.9% ნატრიუმის ქლორიდის ექვივალენტი) ჯგუფებს შორის 3 დღის განმავლობაში. პირველადი საბოლოო წერტილი იყო ვენტილაციის პირველი ეპიზოდი რანდომიზებული განაწილების დაწყებიდან 28-ე დღემდე.
კვლევის შედეგებმა აჩვენა, რომ 28 დღის შემდეგ, ამიკაცინის ჯგუფში 62 პაციენტს (15%) განუვითარდა ვაგინალური აშლილობის სინდრომი (VAP), ხოლო პლაცებოს ჯგუფში 95 პაციენტს (22%) - ვაგინალური აშლილობის სინდრომი (VAP-ის შემთხვევაში გადარჩენის შეზღუდული საშუალო სხვაობა იყო 1.5 დღე; 95% CI, 0.6~2.5; P=0.004).
უსაფრთხოების თვალსაზრისით, ამიკაცინის ჯგუფში შვიდ პაციენტს (1.7%) და პლაცებოს ჯგუფში ოთხ პაციენტს (0.9%) განუვითარდა კვლევასთან დაკავშირებული სერიოზული გვერდითი მოვლენები. მათ შორის, ვისაც რანდომიზაციის დროს თირკმლის მწვავე დაზიანება არ აღენიშნებოდა, ამიკაცინის ჯგუფში 11 პაციენტს (4%) და პლაცებოს ჯგუფში 24 პაციენტს (8%) 28-ე დღეს თირკმლის მწვავე დაზიანება აღენიშნებოდა (HR, 0.47; 95% CI, 0.23~0.96).
კლინიკურ კვლევას სამი მნიშვნელოვანი მომენტი ჰქონდა. პირველ რიგში, კვლევის დიზაინის თვალსაზრისით, AMIKINHAL კვლევა ეფუძნება IASIS კვლევას (რანდომიზებული, ორმაგად ბრმა, პლაცებო-კონტროლირებადი, პარალელური მე-2 ფაზის კვლევა, რომელშიც 143 პაციენტი მონაწილეობდა). ამიკაცინ-ფოსფომიცინის ინჰალაციის სისტემური მკურნალობის უსაფრთხოებისა და ეფექტურობის შესაფასებლად, VAP-ით გამოწვეული გრამუარყოფითი ბაქტერიული ინფექციის (VAP) პრევენციაზე ორიენტირებული ამიკაცინ-ფოსფომიცინის ინჰალაციის სისტემური მკურნალობისა და INHALE კვლევის შედეგები უარყოფითი შედეგებით დასრულდა, რაც შედარებით კარგ შედეგებს იძლევა. მაღალი სიკვდილიანობისა და ხანგრძლივი ჰოსპიტალიზაციის მახასიათებლების გამო, მექანიკური ვენტილაციისა და VAP-ის მქონე პაციენტებში, თუ ამიკაცინის ინჰალაციით შესაძლებელია მნიშვნელოვნად განსხვავებული შედეგების მიღწევა ამ პაციენტებში სიკვდილიანობისა და ჰოსპიტალიზაციის შემცირების თვალსაზრისით, ის უფრო ღირებული იქნება კლინიკური პრაქტიკისთვის. თუმცა, თითოეულ პაციენტსა და თითოეულ ცენტრში დაგვიანებული მკურნალობისა და მოვლის ჰეტეროგენულობის გათვალისწინებით, არსებობს მთელი რიგი შემააშრიალებელი ფაქტორები, რომლებმაც შეიძლება ხელი შეუშალონ კვლევას, ამიტომ ინჰალაციური ანტიბიოტიკებით გამოწვეული დადებითი შედეგის მიღებაც შეიძლება რთული იყოს. ამიტომ, წარმატებული კლინიკური კვლევა მოითხოვს არა მხოლოდ შესანიშნავ კვლევის დიზაინს, არამედ შესაბამისი პირველადი საბოლოო წერტილების შერჩევასაც.
მეორეც, მიუხედავად იმისა, რომ ამინოგლიკოზიდური ანტიბიოტიკები არ არის რეკომენდებული ცალკეული პრეპარატის სახით VAP-ის სხვადასხვა სახელმძღვანელოში, ამინოგლიკოზიდური ანტიბიოტიკები შეიძლება მოიცავდეს VAP პაციენტებში გავრცელებულ პათოგენებს (მათ შორის pseudomonas aeruginosa, acinetobacter და ა.შ.), და ფილტვის ეპითელურ უჯრედებში მათი შეზღუდული შეწოვის, ინფექციის ადგილზე მაღალი კონცენტრაციისა და დაბალი სისტემური ტოქსიკურობის გამო. ამინოგლიკოზიდური ანტიბიოტიკები ფართოდ არის სასურველი ინჰალაციურ ანტიბიოტიკებს შორის. ეს ნაშრომი შეესაბამება გენტამიცინის ინტრატრაქეალური შეყვანის ეფექტის ზომის ყოვლისმომცველ შეფასებას ადრე გამოქვეყნებულ მცირე ნიმუშებში, რაც ერთობლივად აჩვენებს ინჰალაციური ამინოგლიკოზიდური ანტიბიოტიკების ეფექტს VAP-ის პრევენციაში. ასევე უნდა აღინიშნოს, რომ ინჰალაციურ ანტიბიოტიკებთან დაკავშირებულ კვლევებში შერჩეული პლაცებო კონტროლის უმეტესობა არის ნორმალური ფიზიოლოგიური ხსნარი. თუმცა, იმის გათვალისწინებით, რომ ნორმალური ფიზიოლოგიური ხსნარის ატომიზებულ ინჰალაციას შეუძლია გარკვეული როლი ითამაშოს ნახველის განზავებასა და ამოსახველებელ საშუალებად გამოყენებაში, ნორმალურმა ფიზიოლოგიურმა ხსნარმა შეიძლება გარკვეული გავლენა მოახდინოს კვლევის შედეგების ანალიზზე, რაც კვლევაში ყოვლისმომცველად უნდა იქნას გათვალისწინებული.
გარდა ამისა, მნიშვნელოვანია HAP/VAP მედიკამენტების ადგილობრივი ადაპტაცია, ისევე როგორც ანტიბიოტიკების პროფილაქტიკა. ამავდროულად, ინტუბაციის ხანგრძლივობის მიუხედავად, ადგილობრივი ინტენსიური თერაპიის განყოფილების ეკოლოგია წარმოადგენს მრავალწამლის მიმართ რეზისტენტული ბაქტერიებით ინფექციის ყველაზე მნიშვნელოვან რისკ-ფაქტორს. ამიტომ, ემპირიული მკურნალობა მაქსიმალურად უნდა ეფუძნებოდეს ადგილობრივი საავადმყოფოების მიკრობიოლოგიურ მონაცემებს და არ უნდა იყოს ბრმად მიმართული მესამეული საავადმყოფოების გაიდლაინებზე ან გამოცდილებაზე. ამავდროულად, კრიტიკულად დაავადებულ პაციენტებს, რომლებიც საჭიროებენ მექანიკურ ვენტილაციას, ხშირად აქვთ მრავალსისტემური დაავადებები და მრავალი ფაქტორის, მაგალითად, სტრესული მდგომარეობის, კომბინირებული მოქმედების ქვეშ, შესაძლოა ასევე მოხდეს ნაწლავის მიკრობების ფილტვებთან ურთიერთქმედების ფენომენი. შინაგანი და გარეგანი სუპერპოზიციით გამოწვეული დაავადებების მაღალი ჰეტეროგენულობა ასევე განსაზღვრავს, რომ თითოეული ახალი ჩარევის ფართომასშტაბიანი კლინიკური ხელშეწყობა ჯერ კიდევ გრძელი გზაა გასავლელი.
გამოქვეყნების დრო: დეკემბერი-02-2023