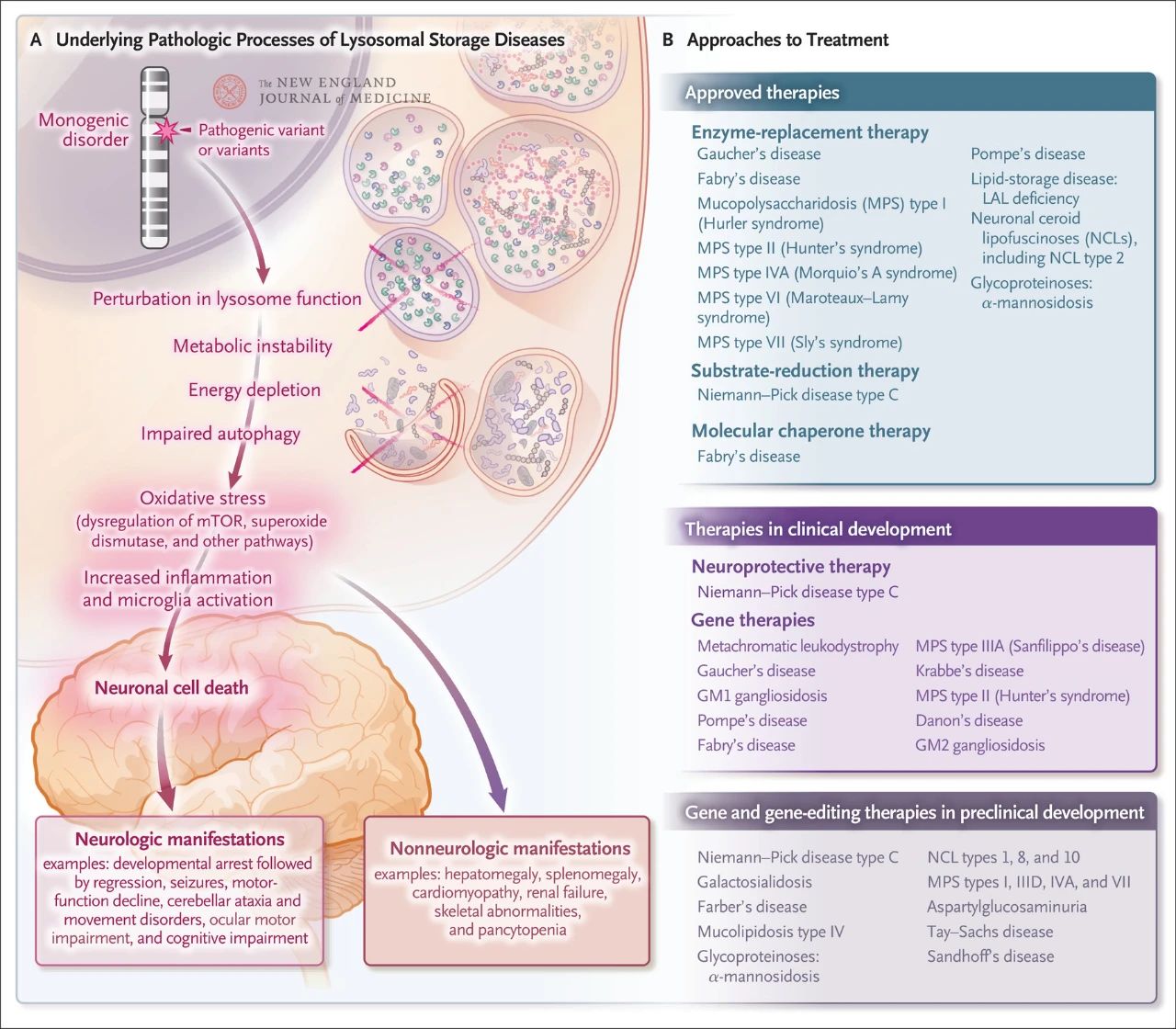
მიუხედავად იმისა, რომ შედარებით იშვიათია, ლიზოსომური დაგროვების საერთო სიხშირე დაახლოებით 1 შემთხვევაა ყოველ 5000 ცოცხალ დაბადებიდან. გარდა ამისა, თითქმის 70 ცნობილი ლიზოსომური დაგროვების დარღვევიდან 70% გავლენას ახდენს ცენტრალურ ნერვულ სისტემაზე. ეს ერთგენური დარღვევები იწვევს ლიზოსომურ დისფუნქციას, რაც იწვევს მეტაბოლურ არასტაბილურობას, რაპამიცინის ძუძუმწოვრების სამიზნე ცილის (mTOR, რომელიც ჩვეულებრივ თრგუნავს ანთებას) დისრეგულაციას, აუტოფაგიის დარღვევას და ნერვული უჯრედების სიკვდილს. დამტკიცებულია ან შემუშავების პროცესშია ლიზოსომური დაგროვების დაავადების ძირითადი პათოლოგიური მექანიზმების საწინააღმდეგო რამდენიმე თერაპია, მათ შორის ფერმენტების ჩანაცვლებითი თერაპია, სუბსტრატის შემცირების თერაპია, მოლეკულური შაპერონული თერაპია, გენური თერაპია, გენების რედაქტირება და ნეიროპროტექტორული თერაპია.
ნიმან-პიკის დაავადება ტიპი C არის ლიზოსომური შენახვის უჯრედული ქოლესტერინის ტრანსპორტირების დარღვევა, რომელიც გამოწვეულია NPC1-ში (95%) ან NPC2-ში (5%) ბიალელური მუტაციებით. ნიმან-პიკის დაავადების C ტიპის სიმპტომები მოიცავს სწრაფ, ფატალურ ნევროლოგიურ დაქვეითებას ჩვილობის ასაკში, ხოლო გვიანი არასრულწლოვანთა, არასრულწლოვანთა და ზრდასრულთა დაწყების ფორმებში შედის სპლენომეგალია, სუპრანუკლეარული მზერის დამბლა და ნათხემის ატაქსია, დისარტიკულაცია და პროგრესირებადი დემენცია.
ჟურნალის ამ ნომერში, ბრემოვა-ერტლი და სხვები წარმოადგენენ ორმაგად ბრმა, პლაცებო-კონტროლირებადი, კროსოვერი კვლევის შედეგებს. კვლევაში გამოყენებული იყო პოტენციური ნეიროპროტექტორული აგენტი, ამინომჟავის ანალოგი N-აცეტილ-L-ლეიცინი (NALL), ნიმან-პიკის C ტიპის დაავადების სამკურნალოდ. მათ ჩართეს 60 სიმპტომური მოზარდი და ზრდასრული პაციენტი და შედეგებმა აჩვენა ატაქსიის შეფასებისა და შეფასების შკალის საერთო ქულის (პირველადი საბოლოო წერტილის) მნიშვნელოვანი გაუმჯობესება.
N-აცეტილ-DL-ლეიცინის (ტანგანილი), NALL-ისა და n-აცეტილ-D-ლეიცინის რაცემიის კლინიკური კვლევები, როგორც ჩანს, დიდწილად გამოცდილებაზეა დამოკიდებული: მოქმედების მექანიზმი ნათლად არ არის განმარტებული. N-აცეტილ-dl-ლეიცინი მწვავე თავბრუსხვევის სამკურნალოდ დამტკიცებულია 1950-იანი წლებიდან; ცხოველებზე ჩატარებული კვლევები ვარაუდობენ, რომ პრეპარატი მოქმედებს მედიალური ვესტიბულური ნეირონების ზედმეტად პოლარიზაციისა და დეპოლარიზაციის რებალანსირებით. შემდგომში, სტრუპმა და სხვებმა გამოაქვეყნეს მოკლევადიანი კვლევის შედეგები, რომელშიც მათ დააკვირდნენ სიმპტომების გაუმჯობესებას სხვადასხვა ეტიოლოგიის დეგენერაციული ცერებრული ატაქსიის მქონე 13 პაციენტში, რამაც ხელახლა გააღვივა ინტერესი პრეპარატის ხელახალი შესწავლის მიმართ.
მექანიზმი, რომლითაც n-აცეტილ-DL-ლეიცინი აუმჯობესებს ნერვული ფუნქციის ფუნქციას, ჯერ კიდევ არ არის ნათელი, თუმცა ორ თაგვის მოდელზე ჩატარებულმა მონაცემებმა, ერთ-ერთში ნიმან-პიკის C ტიპის დაავადების, ხოლო მეორეში GM2 განგლიოზიდის დაგროვების დარღვევის O ვარიანტის (სანდჰოფის დაავადება), კიდევ ერთი ნეიროდეგენერაციული ლიზოსომური დაავადების დროს, ყურადღება NALL-ზე გადაიტანა. კერძოდ, n-აცეტილ-DL-ლეიცინით ან NALL-ით (L-ენანტიომერებით) ნამკურნალები Npc1-/- თაგვების გადარჩენა გაუმჯობესდა, ხოლო n-აცეტილ-D-ლეიცინით (D-ენანტიომერებით) ნამკურნალები თაგვების გადარჩენა არ გაუმჯობესდა, რაც იმაზე მიუთითებს, რომ NALL პრეპარატის აქტიური ფორმაა. GM2 განგლიოზიდის დაგროვების დარღვევის O ვარიანტის (Hexb-/-) მსგავს კვლევაში, n-აცეტილ-DL-ლეიცინმა თაგვებში სიცოცხლის ხანგრძლივობის უმნიშვნელო, მაგრამ მნიშვნელოვანი გახანგრძლივება გამოიწვია.
n-აცეტილ-DL-ლეიცინის მოქმედების მექანიზმის შესასწავლად, მკვლევრებმა გამოიკვლიეს ლეიცინის მეტაბოლური გზა მუტანტი ცხოველების ნათხემის ქსოვილებში მეტაბოლიტების გაზომვით. GM2 განგლიოზიდური დაგროვების დარღვევის O ვარიანტულ მოდელში, n-აცეტილ-DL-ლეიცინი ახდენს გლუკოზისა და გლუტამატის მეტაბოლიზმის ნორმალიზებას, ზრდის აუტოფაგიას და სუპეროქსიდდისმუტაზას (აქტიური ჟანგბადის შემგროვებელი) დონეს. ნიმან-პიკის დაავადების C მოდელში დაფიქსირდა გლუკოზისა და ანტიოქსიდანტური მეტაბოლიზმის ცვლილებები და მიტოქონდრიული ენერგეტიკული მეტაბოლიზმის გაუმჯობესება. მიუხედავად იმისა, რომ L-ლეიცინი არის ძლიერი mTOR აქტივატორი, n-აცეტილ-DL-ლეიცინით ან მისი ენანტიომერებით მკურნალობის შემდეგ თაგვის არცერთ მოდელში არ დაფიქსირებულა mTOR-ის დონის ან ფოსფორილირების ცვლილება.
NALL-ის ნეიროპროტექტორული ეფექტი დაფიქსირდა თაგვის მოდელში, რომელსაც ჰქონდა კორტიკალური დარტყმით გამოწვეული ტვინის დაზიანება. ეს ეფექტები მოიცავს ნეიროანთებითი მარკერების შემცირებას, კორტიკალური უჯრედების სიკვდილის შემცირებას და აუტოფაგიის ნაკადის გაუმჯობესებას. NALL-ით მკურნალობის შემდეგ, დაზიანებული თაგვების მოტორული და კოგნიტური ფუნქციები აღდგა და დაზიანების ზომა შემცირდა.
ცენტრალური ნერვული სისტემის ანთებითი პასუხი ნეიროდეგენერაციული ლიზოსომური დაგროვების დარღვევების უმეტესობის დამახასიათებელი ნიშანია. თუ ნეიროანთების შემცირება შესაძლებელია NALL-ის მკურნალობით, შესაძლოა გაუმჯობესდეს ნეიროდეგენერაციული ლიზოსომური დაგროვების მრავალი, თუ არა ყველა, კლინიკური სიმპტომები. როგორც ეს კვლევა აჩვენებს, NALL-ს ასევე მოსალოდნელია სინერგია ლიზოსომური დაგროვების დაავადების სხვა თერაპიებთან.
ლიზოსომური დაგროვების მრავალი დარღვევა ასევე ასოცირდება ნათხემის ატაქსიასთან. GM2 განგლიოზიდური დაგროვების დარღვევების მქონე ბავშვებისა და მოზრდილების (ტეი-საქსის დაავადება და სენდჰოფის დაავადება) მქონე საერთაშორისო კვლევის თანახმად, NALL-ის მკურნალობის შემდეგ ატაქსია შემცირდა და წვრილი მოტორული კოორდინაცია გაუმჯობესდა. თუმცა, ფართომასშტაბიანმა, მრავალცენტრიანმა, ორმაგად ბრმა, რანდომიზებულმა, პლაცებო-კონტროლირებადმა კვლევამ აჩვენა, რომ n-აცეტილ-DL-ლეიცინი კლინიკურად ეფექტური არ იყო შერეული (მემკვიდრეობითი, არამემკვიდრეობითი და აუხსნელი) ნათხემის ატაქსიის მქონე პაციენტებში. ეს დასკვნა მიუთითებს, რომ ეფექტურობა შეიძლება შეინიშნოს მხოლოდ მემკვიდრეობითი ნათხემის ატაქსიის მქონე პაციენტების და მათი მოქმედების მექანიზმების ანალიზის შემდეგ ჩატარებულ კვლევებში. გარდა ამისა, იმის გამო, რომ NALL ამცირებს ნეიროანთებას, რამაც შეიძლება გამოიწვიოს ტვინის ტრავმული დაზიანება, შეიძლება განიხილებოდეს NALL-ის კლინიკური კვლევები ტრავმული ტვინის დაზიანების სამკურნალოდ.
გამოქვეყნების დრო: 2024 წლის 2 მარტი